Nanopartículas de Ouro no tratamento de doenças
As nanopartículas de ouro exibem características físico-químicas únicas, que podem ser úteis para fins terapêuticos. Depois de duas décadas de estudos pré-clínicos, nanopartículas de ouro (AuNP) estão em transição para ensaios clínicos. Essas aplicações terapêuticas estão relacionadas com a farmacocinética devido aos perfis de biodistribuição das AuNPs, que possuem propriedades optoeletrônicas ajustáveis por meio da química de colóides e da bioengenharia. Por exemplo, é possível produzir AuNP em formato de nanobastões, nanoestrelas e nanoconchas (Fig. 1) com propriedades de proteção de biomoléculas contra degradação, fotodestruição, drug delivery e muito mais. Além disso, a AuNP pode ser diretamente conjugada com diversos peptídeos, sem a necessidade de outros reagentes químicos, o que diminui a toxicidade dos medicamentos potencialmente gerados e auxilia na redução de resíduos químicos na produção industrial.
Figura 1: Arranjos possíveis em nanopartículas.

Fonte: Adaptado de Zhang et al. (2022)
Devido às capacidades das nanopartículas de ouro, seu potencial terapêutico foi aumentado (vide Figura 2). Historicamente, seu uso na forma de sais foi restrito ao tratamento de artrite reumatóide. Atualmente, o uso das AuNP inclui exames de diagnósticos (testes de gravidez e testes rápidos de COVID-19), imagem in vivo (fotoacústica e tomografia computadorizada) e terapêutica (terapia fototérmica, radioterapia e terapia catalítica).
Figura 2: Aplicações das nanopartículas de ouro (AuNP) na medicina.
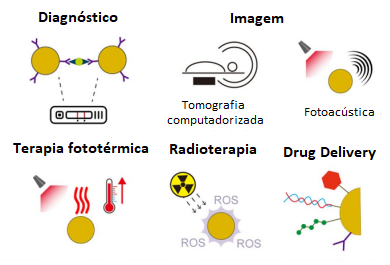
Fonte: Adaptado de Zhang et al. (2022)
Um ramo que está em crescimento exponencial é o uso das AuNP em terapias anti-câncer. A seguir, serão citados estudos em fase clínica:
1- CYT-6091
Este é um fator de necrose tumoral humano (TNF) ligado por amalgamento às AuNP (Figura 3), que age como drug delivery exatamente na região tumoral, onde o TNF precisa atuar. Esse direcionamento do TNF evita que ele se ligue em seus diversos receptores distribuídos ao longo do organismo humano. Como consequência, efeitos adversos sistêmicos são evitados, como o choque séptico, que pode levar à morte do paciente. Após a ligação TNF-AuNP, o tempo de circulação do fator de necrose é significativamente aumentado, causando maior acúmulo dele no tumor, em comparação com TNF livre, ou seja, melhorando sua ação destrutiva contra tumores. A melhora na resposta terapêutica em modelos animais fez com que, em 2006, fossem iniciados os estudos clínicos de fase I em pacientes humanos.
Figura 3: Estrutura da AuNP usada no tratamento com TNF.

Fonte: Adaptado de Zhang et al. (2022)
A forma farmacêutica do CYT-6091 usada nos estudos foi a injeção intravenosa em pacientes com tumores sólidos avançados. Cada paciente recebeu diferentes doses (variaram de 50 a 600 μg/m2), por duas vezes, administradas com 14 dias de intervalo. Todas as doses foram bem toleradas, até as maiores, sem efeito colateral. Isso ocorreu por conta do aumento da ação do TNF nos receptores vizinhos ao tumor, em detrimento dos receptores sistêmicos, devido à nanoformulação. Assim, em julho de 2020, foi anunciado que a empresa de biotecnologia por trás do desenvolvimento do CYT6091 assinou um contrato de ensaio clínico fase II com o National Cancer Institute, o qual se encontra em andamento.
2- C19-A3
Este é peptídeo pró-insulina humana conjugado com AuNP ultra pequeno, que está sendo testado para o tratamento de diabetes tipo 1. A regulação negativa das células T que danificam as células 𝛃, produtoras de insulina, pode ser feita com C19-A3. Sua ação é específica nessas células T, por conta do mecanismo de drug delivery das AuNPs; por isso, não há imunossupressão sistêmica, apenas local. Ainda, C19-A3 apresenta maior captação por células apresentadoras de antígenos. Como consequência disso, pode-se restaurar a homeostase imunológica, freando a destruição dessas células.
Os testes clínicos de fase I do C19-A3-AuNP foram iniciados em 2016, com a administração intradérmica com microagulhas do peptídeo em três doses, espaçadas por 4 semanas. Efeitos colaterais graves (sistêmicos) não foram observados. Porém, houve retardo na reação da pele no local da injeção, que gradualmente desapareceu ao longo do estudo, e hipersensibilidade local ao ouro, avaliado por teste de contato epicutâneo. Além disso, não ocorreu retenção de ouro sistêmica, apenas cutânea. Os benefícios desta abordagem (boa tolerância, via de administração minimamente invasiva e potencial efeito terapêutico) podem superar os riscos (retenção de ouro e hipersensibilidade locais). No entanto, são necessários mais estudos clínicos.
3- EMX-001, naNO-DENGUE e naNO-COVID.
As AuNPs também foram exploradas como veículos de entrega de moléculas em vacinas contra dengue (os dois primeiros) e SARS-CoV-2 (o último). As vacinas são coquetéis de células T de peptídeos do vírus da dengue ou coronavírus, conjugado na superfície de um AuNP. A ação das nanopartículas é proteger esses peptídeos da degradação proteolítica prematura e reduzir a quantidade de antígeno necessário para a faixa nanomolar. Sua entrega da carga imunogênica para células apresentadoras de antígeno é muito eficiente, e precisa ser mesmo, devido à tendência de acúmulo dessas nanopartículas em fagócitos.
Os estudos clínicos de fase I iniciaram em 2022, com a injeção de duas doses, no intervalo de 21 dias, tanto para dengue quanto para coronavírus. Duas doses foram aplicadas: 2,5 nmol de peptídeo (12,8 μg de ouro) e 7,5 nmol de peptídeo (38,3 μg ouro). O cálculo da imunogenicidade foi pela proporção de pacientes com células T específicas para peptídeos de dengue e SARS-CoV-2 e a porcentagem de participantes que apresentaram anticorpos contra o vírus da dengue ou coronavírus. Infelizmente, os estudos ainda estão em andamento e, por isso, não há resultados publicados.
4- NU-0129.
Este é um RNA interferente (siRNA) ligado a AuNP (Figura 4) que está sendo explorado como um tratamento promissor de glioblastoma. Assim, é possível silenciar oncogenes como Bcl2L12, que é super expresso nas células mutadas, levando à inibição da apoptose dessas células. Nesse cenário, o papel das AuNps é formar um invólucro em forma de concha ao redor do siRNA, aumentando sua estabilidade a partir da proteção contra a degradação de nucleases. Além disso, esse arranjo forma interações polivalentes que o permitem atravessar a barreira hematoencefálica, realizando a entrega de siRNA nas lesões de glioblastoma, capazes de silenciar Bcl2L12, ativar a apoptose das células mutadas e, assim, reduzir o tumor.
Figura 4: Estrutura da nanopartícula acoplada ao siRNA.
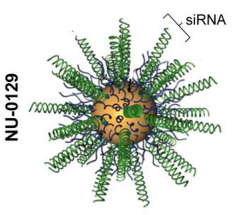
Fonte: Adaptado de Zhang et al. (2022)
Um ensaio clínico fase 0 foi concluído em 2020 para avaliar a segurança, penetração intratumoral e o efeito supressor de oncoproteínas pelo NU-0129, o qual foi administrado em pacientes com glioblastoma recorrente submetidos à cirurgia. O sucesso disso levou ao início de estudos de fase I onde NU-0129 acumulou-se na região tumoral, com 20% desses arranjos localizados no interior das células tumorais. Isso induziu uma redução na expressão da proteína Bcl2L12 associada ao tumor. Entretanto, foi detectado o acúmulo de AuNP a longo prazo em tumores de dois pacientes, o que indica a necessidade de mais estudos clínicos para avaliar a eficácia terapêutica dessas nanoconstruções.
5- Partículas AuroShell (nanoconchas de ouro)
Essas partículas constituem um tipo de AuNP usado para a destruição fototérmica de tumores sólidos. São compostas por um núcleo de sílica coberto por uma camada fina de ouro (Figura 5), produzindo uma AuNP que exibe forte coeficiente de extinção na região do infravermelho, onde a luz possui propriedades de penetração mais profunda em tecidos. Essa conformação da partícula de ouro concentra a energia térmica por absorção e conversão fototérmica na vizinhança do tumor. O calor local gerado desencadeia apoptose e necrose de células cancerígenas, destruindo-as por irradiação (Figura 6).
Figura 5: Estrutura da nanoconcha de ouro.
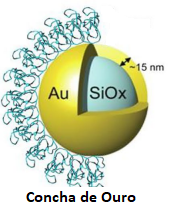
Fonte: Adaptado de Zhang et al. (2022)
Figura 6: Mecanismo de liberação de calor no tumor a partir do uso da nanoconcha de ouro
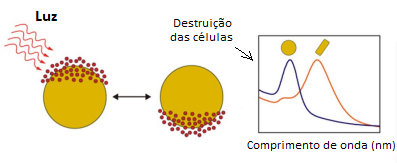
Fonte: Adaptado de Zhang et al. (2022)
Em 2015 foram publicados os resultados dos primeiros estudos clínicos de segurança desse sistema, que foram feitos administrando nanoconchas de ouro de forma intravenosa em dose única nos pacientes com câncer de próstata. Durante todo o estudo, foram observados apenas dois relatos de efeitos adversos: uma reação alérgica que foi resolvida com anti-histamínicos e uma sensação de queimação epigástrica. Uma continuação dos ensaios clínicos foi iniciada em 2016, visando avaliar os benefícios terapêuticos da fotodestruição do tumor de próstata em 16 pacientes. O tratamento com nanoconchas de ouro obteve sucesso com 15 dos 16 pacientes; esse único negativo não avançou no tratamento a laser porque apresentou dor epigástrica após a administração. As áreas de destruição estavam livres de câncer em 60% dos pacientes, 3 meses após o tratamento, e 87%, após 12 meses do início do tratamento. Além disso, há um relato de caso de 100% de destruição do tumor segmentado em um paciente tratado com nanoconchas de ouro em 2022, além de 94% das margens tumorais terem sido reduzidas. Ainda estão sendo feitos testes clínicos que fornecerão mais resultados sobre a eficácia e o potencial clínico futuro da terapia.
Além do tratamento do câncer de próstata, as nanoconchas de ouro também foram usadas na clínica para destruir foto-termicamente placas de aterosclerose e restaurar o fluxo sanguíneo. Em 2016, foi concluído o estudo onde foram testadas duas formas de administração. Na primeira, 60 pacientes receberam as nanoconchas de ouro carregadas com células-tronco cultivadas em artéria. O papel das células-tronco foi duplo, ou seja, atuar como entregadores e ajudar na cicatrização do tecido após o tratamento agressivo de fotodestruição. Na segunda abordagem, 60 pacientes receberam, via infusão na artéria coronária, uma mistura 1:1 de células-tronco e microbolhas carregadas com nanoconchas de ouro e de ouro marcado com ferro. O ferro permitiu o direcionamento magnético, enquanto as microbolhas foram destruídas por pulsos de ultrassom para liberar uma fração das nanoconchas na área de interesse. Já no grupo controle de 60 pacientes, estes foram submetidos a implante de stent, o tratamento convencional para essa doença. Um ano após o tratamento, a proporção da parede do vaso ocupada por placa aterosclerótica foi o mais baixo no grupo da primeira abordagem (38%), comparado ao grupo da segunda abordagem (39%) e ao grupo controle (53%). Ademais, os resultados relativos aos pacientes, publicados em 2017, corroboraram com as primeiras observações de que a primeira abordagem possui a menor mortalidade e menos eventos cardiovasculares adversos. Apesar desses resultados promissores, estudos adicionais com mais pacientes são necessários.
6- CNM-Au8
O CNM-Au8 é uma nanopartícula veiculada em uma solução de administração oral de bicarbonato, para tratamento de vários distúrbios neurodegenerativos, incluindo esclerose lateral amiotrófica (ELA) e Parkinson. Os AuNP são cristais de ouro de superfície limpa, que apresentam propriedades catalíticas de óxido-redução, em processos biológicos intracelulares. Por exemplo, AuNP pode catalisar a oxidação de NADH em NAD+, um cofator fundamental para a síntese de ATP. Assim, espera-se que CNM-Au8 restaure os déficits de energia celular, diminuindo o estresse oxidativo associado a múltiplas neuropatologias.
Estudos pré-clínicos demonstraram a entrega de CNM-Au8 para a coluna vertebral, medula e cérebro de caninos após administração oral. Em julho de 2019, a agência americana de controle FDA concedeu ao CNM-Au8 a designação de medicamento órfão para ELA. Depois de alguns meses, estudos de fase II e uma fase multicêntrica II/III foram iniciados. Pacientes com ELA foram tratados diariamente com 30 ou 60 mg de CNM-Au8 por 36 e 24 semanas, respectivamente. A conclusão foi que, apesar de não atender aos requisitos dos biomarcadores primários e secundários associados à prevenção da perda do neurônio motor e o declínio da função pulmonar, o tratamento retardou significativamente a progressão da doença. Essa evidência de benefício de sobrevivência a longo prazo foi o suficiente devido ao sofrimento desencadeado pela ELA, considerando que a AuNP é segura.
Fora desses ensaios, há um programa de acesso expandido para até 30 pacientes com ELA no Hospital Geral de Massachusetts para receber o CNM-Au8. Em 15 de agosto de 2022, foram relatados resultados positivos para CNM-Au8 na Fase II, pois a nanoformulação atendeu aos biomarcadores primários e secundários em comparação com placebo.
Para mais informações, acesse o artigo original na íntegra: ZHANG, Rui; KIESSLING, Fabian; LAMMERS, Twan; PALLARES, Roger M.. Clinical translation of gold nanoparticles. Drug Delivery And Translational Research, [S.L.], v. 13, n. 2, p. 378-385, 31 ago. 2022. Springer Science and Business Media LLC. http://dx.doi.org/10.1007/s13346-022-01232-4.


