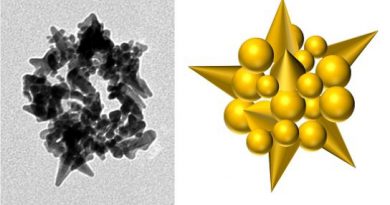
Nanofármaco multifuncional livre de carreadores para o tratamento de câncer de ovário
O câncer ovariano é o câncer ginecológico mais letal conhecido atualmente, por ser normalmente diagnosticado em estágio mais avançado e se espalhar rapidamente pelo corpo. Apesar do avanço no diagnóstico e tratamento para essa doença, a taxa de sobrevivência em cinco anos é apenas de 25 a 30%, sendo necessário o desenvolvimento de estratégias que possam promover a morte e a inibição da migração de células cancerosas, diminuindo sua letalidade.
Uma importante característica de seu estágio de metástase é a ascite maligna gerada pela infiltração do peritônio, sendo uma das principais causas de morte dos pacientes. Assim, além do tradicional uso de cirurgias e quimioterapia baseada em platina, um tratamento que vem ganhando destaque e interesse nos últimos anos, para esse tipo de câncer, é a quimioterapia intraperitoneal, que aumenta a citotoxicidade às células cancerosas, inibindo sua produção e, consequentemente, o desenvolvimento de ascite e aumentando a exposição do tumor a agentes antineoplásicos. Os problemas desse tratamento, entretanto, são encontrados por efeitos sistêmicos gerados por seu caminho de entrada de escolha, a barreira peritônio-vascular, e a resistência a medicamentos.
Estudos recentes, então, mostraram que os grandes responsáveis pela contínua proliferação e resistência dessas células tumorais são as largas regiões de super-acentuassomos, altamente ocupadas por fatores de transcrição e cofatores, que realizam a transcrição constante dos oncogenes. Consequentemente, a inibição desses acentuassomos seria de extremo interesse clínico, pois suprimiria a proliferação das células tumorais.
O inibidor THZ1, voltado à transcrição, é um novo composto capaz de reduzir significativamente a atividade dos acentuassomos e de fatores de transcrição dos oncogenes, sendo especialmente citotóxico para células da linhagem de câncer ovariano. Uma das suas limitações, contudo, é a sua meia vida, de apenas 45 minutos no plasma, segundo testes laboratoriais. Desse modo, é interessante pensar em estratégias que possam aumentar sua biodisponibilidade, como a técnica desenvolvida no artigo base desse texto, chamada ACaT. Nesta estratégia, é produzido um nanofármaco sem carreador para câncer de ovário com disseminação intraperitoneal, composto de alendronato, THZ1 e Ca2+. Essa combinação permite não só uma maior estabilidade ao THZ1, como pode especificamente ser focada no tumor, simultaneamente impedindo sua migração e aumentando sua apoptose. Ademais, esse composto pode ser degradado em pH baixo e mostrou ter boa biocompatibilidade.
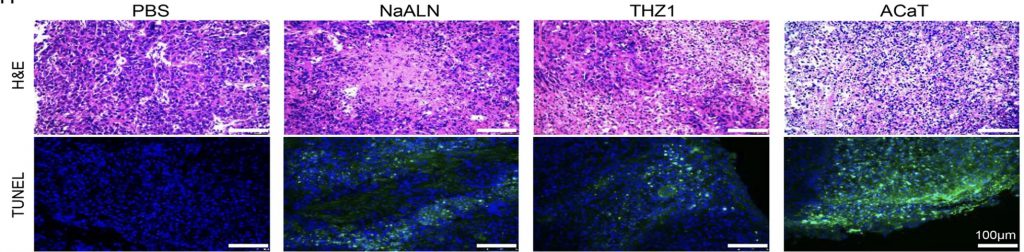
Ao fim, a partir de testes realizados pelos autores do artigo, como, por exemplo, os representados na imagem 1, foi possível comprovar o sucesso desse nanofármaco, que, quando internalizado pelas células tumorais, teve sucesso em induzir a parada do ciclo celular, apoptose e inibir a migração celular por meio da liberação de medicamento anticâncer. Sendo assim, é possível afirmar que o ACaT pode ser considerado um possível futuro tratamento para cânceres de ovário de estágio avançados.
Fonte: HUANG, Xiuyu et al. Carrier-free multifunctional nanomedicine for intraperitoneal disseminated ovarian cancer therapy. Journal of Nanobiotechnology, [s. l.], v. 20, n. 93, 22 fev. 2022. DOI https://doi.org/10.1186/s12951-022-01300-4. Disponível em: https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-022-01300-4. Acesso em: 14 abr. 2022.